Geral
Questões de Química para o Enem – Prof. Stefanny Alencar
Terça-feira, 29 Dezembro de 2020 - 11:37 | da Redação

Oi galera, nesse primeiro momento escolhi para vocês um tema dentro de Físico-Química chamado Eletroquímica: Pilhas e Eletrólise, tendo em vista que após um levantamento das provas do ENEM de 2009 até 2018, é o que aparece em 1º lugar com 90 questões, cerca de 26,7% do total. Continue estudando, essa é a reta final e tenho certeza que sairão vitoriosos.
1) Pilhas são dispositivos que produzem corrente elétrica, explorando as diferentes capacidades das espécies de perderem ou de ganharem elétrons. A figura abaixo mostra a montagem de uma dessas pilhas:
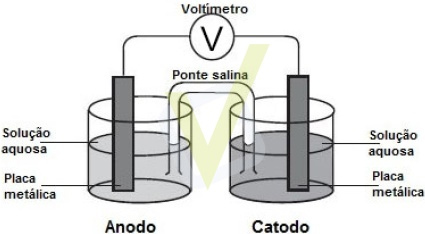
A seguir, estão representadas algumas semirreações e seus respectivos potenciais de redução, a 25º C:
Aℓ3+ (aq) + 3e--→ Aℓ (s) Eo = -1,66 V
Ni2+ (aq) + 2e--→ Ni (s) Eo = -0,25 V
Mg+2 (aq) + 2e--→ Mg (s) Eo= -2,37 V
Fe+2 (aq) + 2e--→ Fe (s) Eo = -0,44 V
A pilha de maior diferença de potencial (ddp) pode ser constituída no anodo e no catodo, respectivamente, pelos eletrodos de
a) alumínio e magnésio.
b) magnésio e níquel.
c) alumínio e ferro.
d) ferro e níquel.
Resolução:
Letra A
A maior ddp é gerada pela pilha de magnésio e níquel, ou seja, o maior potencial com o menor potencial.
2) O esquema abaixo representa a pilha ferro-hidrogênio (eletrodo-padrão).
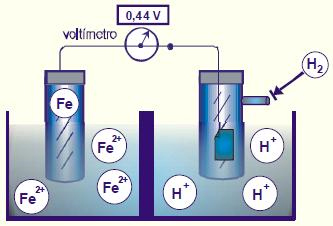
O voltímetro indica a força eletromotriz em condições-padrão. O anodo dessa pilha e o potencial-padrão de redução do ferro são, respectivamente:
a) eletrodo de ferro e – 0,44 V.
b) eletrodo de ferro e + 0,22 V.
c) eletrodo de ferro e + 0,44 V.
d) eletrodo de hidrogênio e – 0,44 V.
e) eletrodo de hidrogênio e + 0,44 V.
Resolução:
Letra A
O ferro sofre oxidação, isto é, compõe o ânodo da pilha. O potencial de redução do ferro é negativo, pois está sofrendo, ou seja, a leitura do voltímetro (-0,44 V)
3) A primeira pilha elétrica produzida pelo italiano Alessandro Volta, em 1800, consistia em discos de Zn e Ag metálicos, separados por discos de papelão molhados com solução aquosa de cloreto de sódio. Desde então, vários outros modelos e combinações de elementos foram sendo propostos. Uma das pilhas mais simples é a de Daniell, a qual é obtida da montagem adequada das semicélulas Cu2+/Cu0 e Zn2+/Zn0 .
Considerando as informações, assinale a alternativa correta.
a) O potencial padrão da pilha é de -1,10 v.
b) O potencial padrão da pilha é de 0,76 v.
c) O anodo de cobre tem polaridade negativa.
d) O potencial Eo(Cu/Cu2+) é 0,34 v.
e) O anodo é formado pela semicélula do zinco.
Resolução:
Letra E
O zinco é ânodo, enquanto o cobre é cátodo dessa pilha. A ddp é igual a 1,10V.
ddp = EoRed Maior - EoRed Menor
4) Sob a perspectiva da termodinâmica, deve-se realizar trabalho não espontâneo para combater a desordem. Sistemas químicos que exploram reações químicas de oxidação e redução podem realizar trabalhos espontâneos ou não espontâneos. Sobre reações químicas em pilhas e em processos de eletrólise de soluções aquosas e de compostos fundidos, assinale a alternativa correta.
a) Em um processo de eletrólise, os elétrons fluem do cátodo para o ânodo em um processo espontâneo.
b) Em um processo de eletrólise, a energia elétrica é convertida em energia química através de um processo não espontâneo.
c) Em uma pilha galvânica, a energia elétrica é convertida em energia química através de um processo não espontâneo.
d) Em uma pilha galvânica, a reação espontânea apresenta um valor negativo de ∆Eº, com geração de energia sob a forma de trabalho.
e) Em uma pilha galvânica, há um processo não espontâneo, na qual o cátodo é o polo negativo e o ânodo é o polo positivo.
Resolução:
Letra B
Durante a Eletrólise, a energia elétrica é convertida em energia química, em um processo não espontâneo.
5) A bauxita é o minério utilizado na fabricação do alumínio, a qual apresenta Al2O3 (alumina) em sua composição. Após o trituramento e lavagem para reduzir o teor de impurezas, o minério é misturado a uma solução aquosa de NaOH (etapa A). A parte sólida dessa mistura é rejeitada e a solução resultante recebe pequenos cristais de alumina, de onde sedimenta um sólido (etapa B). Esse sólido é aquecido até a obtenção de um pó branco, isento de água e constituído unicamente por alumina. Finalmente, esse pó é aquecido até sua fusão e submetido a uma eletrólise, cujos produtos são o metal puro fundido (AI) e o gás carbônico (CO2)
Nesse processo, as funções das etapas A e B são, respectivamente,
A) oxidar a alumina e outras substâncias e reduzir seletivamente a alumina.
B) solubilizar a alumina e outras substâncias e induzir a precipitação da alumina.
C) solidificar as impurezas alcalinas e deslocar o equilíbrio no sentido da alumina.
D) neutralizar o solo ácido do minério e catalisar a reação de produção da alumina.
E) romper as ligações químicas da alumina e diminuir o calor de formação do alumínio
Resolução:
Letra B
5) Nesse processo, as funções das etapas A e B são, respectivamente, solubilizar a alumina e outras induzir a precipitação da alumina.
Na etapa A, o minério é misturado a uma solução aquosa de NaOH.
Al(OH)3(s) + NaOH(aq) → NaAl(OH)4(aq)
Ou
AlO(OH)(S) + NaOH(aq) + H2O(l) → NaAl(OH)4(aq)
Na etapa B, a parte solida dessa mistura é rejeitada e a solução resultante recebe pequenos cristais de alumina (semeadura), da qual sedimenta um solido, o Al(OH)3
NaAl(OH)4(aq) → Al(OH)3(s) + NaOH(aq)
Posteriormente,
2 Al(OH)3(s) → Al2O3 + 3 H2O(g)
*Stefanny Alencar é professora de Química da Escola Major Guapindaia.




